العناصر الانتقالية الداخلية … عناصر تحت المستوى f (اللانثانيدات والاكتينيدات)
بزيادة العدد الذري يتابع فيها امتلاء تحت المستوى 4f و 5f الذي يتسع كل منهما لأربعة عشر إلكتروناً وعلى ذلك تتكون من سلسلتين أفقيتين تتكون كل منهما من أربعة عشر عنصراً وموقعهما مفصول عادة أسفل الجدول الدوري لأنّ خواصها لا تتفق مع خواص العناصر الانتقالية. وهاتان السلسلتان هما سلسلة الاكتينيدات وسلسلة اللانثانيدات.
1. سلسلة اللانثانيدات Lanthanides

سلسلة اللانثانيدات تتكون من 14 عنصر أرضي نادر تبدأ من سيريوم إلى لوتيتسيوم في الجدول الدوري، بالأرقام الذرية من 58 إلى 71، وبعض العلماء يضيف إليهم عنصر لانثانوم 57 الذي يسبقهم في الجدول الدوري. وترجع تسمية سلسلة اللانثينيدات إلى عنصر اللانثانوم رغم أنه لا يوجد فيها (طبقا لبعض العلماء) . وتلى سلسة اللانثينيدات سلسة الأكتينيدات.
وتتكون سلسلة اللانثينيدات من سلسلة عناصر متتالية يكون فيها المدار F ممتلئاً جزئياً أو كلياً بالإلكترونات، بينما تكون المدارات الخارجية فارغة.
ويتم وضع سلسة اللانثينيدات تحت الجدول الدوري كما لو كانت تذييل له. بينما يوضح الجدول الدوري الطويل المكان الفعلى لمجموعة اللانثينيدات.
| الترتيب الإلكتروني للانثانيدات | |||||||
| العنصر | الرمز | العدد الذري | الترتيب الإلكتروني | ||||
| المثالي | المحتمل | ||||||
| Lanthanum لانثانوم | La | 57 | 6s2 | 5d1 | 6s2 | 5d1 | |
| Cerium سيريوم | Ce | 58 | 6s2 | 5d1 | 4f1 | 6s2 | 4f2 |
| Praseodymium براسيوديميوم | Pr | 59 | 6s2 | 5d1 | 4f2 | 6s2 | 4f3 |
| Neodymium نيوديميوم | Nd | 60 | 6s2 | 5d1 | 4f3 | 6s2 | 4f4 |
| Promethium برومثيوم | Pm | 61 | 6s2 | 5d1 | 4f4 | 6s2 | 4f5 |
| Samarium سماريوم | Sm | 62 | 6s2 | 5d1 | 4f5 | 6s2 | 4f6 |
| Europium يربيوم | Eu | 63 | 6s2 | 5d1 | 4f6 | 6s2 | 4f7 |
| Gadolinium كادولينيوم | Gd | 64 | 6s2 | 5d1 | 4f7 | 6s2 | 4f7 |
| Terbium تربيوم | Tb | 65 | 6s2 | 5d1 | 4f8 | 6s2 | 4f9 |
| Dysprosium ديسبريسيوم | Dy | 66 | 6s2 | 5d1 | 4f9 | 6s2 | 4f10 |
| Holmium هوليوم | Ho | 67 | 6s2 | 5d1 | 4f10 | 6s2 | 4f11 |
| Erbium اربيوم | Er | 68 | 6s2 | 5d1 | 4f11 | 6s2 | 4f12 |
| Thulium ثوليوم | Tm | 69 | 6s2 | 5d1 | 4f12 | 6s2 | 4f13 |
| Ytterbium يتيربيوم | Yb | 70 | 6s2 | 5d1 | 4f13 | 6s2 | 4f14 |
| Lutetium لوتيتيوم | Lu | 71 | 6s2 | 5d1 | 4f14 | 6s2 | 4f14 |
2. سلسلة الأكتينيدات Actinides

بزيادة العدد الذري يتتابع فيها امتلاء تحت المستوى 5f وهي تقع في الدورة السابعة بعد الأكتينيوم وتبدأ بالثوريوم وتنتهي بعنصر النوبليوم وتسمى الأكتينيدات أيضاً بالعناصر المشعة لأنّ جميعها يتميز بالنشاط الإشعاعي نتيجة لعدم ثبووت أنويتها ولا يوجد في الطبيعة من الأكتينيدات سوى عنصر الثوريوم والبروتواكتينيوم واليورانيوم أما بقية العناصر التي بعد اليورانيوم فهي عناصر مصنعة تم إنتاجها في المفاعلات النووية وذلك بقذف أنوية العناصر الثقيلة بنيوترونات أو بروتونات عناصر خفيفة مثل الهيليوم أو الكربون. وهي لها خواص تشبه لعناصر سلسة اللانثانيدات. الأكتينيدات ذات الأرقام الذرية العالية لا توجد في الطبيعة ولها فترة عمر نصف صغيرة ويتم وضع سلسة الأكتينيدات تحت الجدول الدوري كما لو كانت تذييل له.
بينما يوضح الجدول الدوري الطويل المكان الفعلي
| العناصرElement | Electron Configurationالترتيب الاكتروني للاكتينيدات بطريقة العازات النبيلة |
Thorium (Th) | [Rn]7s26d2 |
| Protactinium (Pa) | [Rn]7s25f26d1 |
| Uranium (U) | [Rn]7s25f36d1 |
| Neptunium (Np) | [Rn]7s25f46d1 |
| Plutonium (Pu) | [Rn]7s25f6 |
Americium (Am) | [Rn]7s25f7 |
| Curium (Cm) | [Rn]7s25f76d1 |
| Berkelium (Bk) | [Rn]7s25f9 |
| Californium (Cf) | [Rn]7s25f10 |
| Einsteinium (Es) | [Rn]7s25f11 |
| Fermium (Fm) | [Rn]7s25f12 |
Mendelevium (Md) | [Rn]7s25f13 |
| Nobelium (No) | [Rn]7s25f14 |
| Lawrencium (Lr) | [Rn]7s25f146d1 |
وتغلب على هذه العناصر في مركباتها حالة الأكسدة +3، وتظهر في بعضها الحالتان +2 و +4 وتعد الحالة +3 الحالة الوحيدة الأكثر ثباتاً في اللانثانيوم والكادولينيوم واللوتسيوم لأنها تتوافق مع شغور المدار 4f فيها وامتلائها إلى النصف ثم امتلائها الكامل.
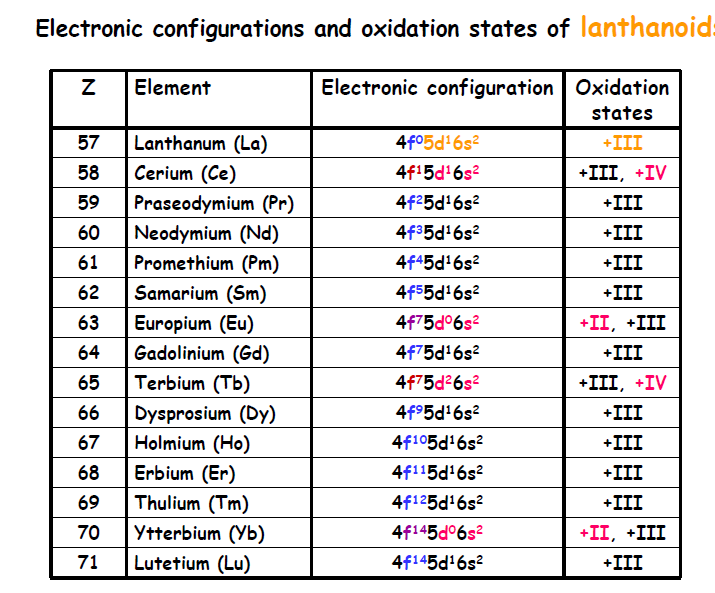
أعداد الأكسدة الشائعة للانثانيدات


























































