تجربة تقدير التركيز المولاري لهيدروكسيد الصوديوم

الجزء النظري:
أنواع المحاليل:
1. المحلول الآيوني (Ion Solution): هو المحلول الناتج من إذابة مادة صلبة آيونية في محلول وينتج عندما تكون المادة المذابة تحوي على آصرة آيونية.
NaCl↔Na+ + Cl–
2. المحلول الجزيئي (Molecular Solution): هو المحلول الذي يحتوي آصرة تساهمية في المادة المذابة.
3. المحلول القياسي (Standard Solution): هو المحلول المعلوم الحجم والمضبوط التركيز والذي يعول عليه في إستخراج تراكيز العينات اوالنماذج المعطاة.
مواصفات المحلول القياسي (Specifications of the Standard Solution):
- أن يبقى تركيزه ثابت لبضعة أشهر.
- أن يكون التفاعل بين مادة المحلول القياسي والمادة المراد تقديرها تفاعلا آنياً وسريعاً.
- أن يكون التفاعل تام وغير عكسي وذلك ضروري للحصول على نقطة تكافؤ واضحة.
- إمكانية التعبير عن التفاعلات بالمعادلات الكيميائية المتوازنة.
- أن يعطي كاشف المحلول القياسي نقطة تكافؤ واضحة يعول عليها حسابياً في تقدير المادة المجهولة.
المادة المستعملة في تحضير المحلول القياسي تسمى المادة القياسية الأولية (Primary standard material) والتي يمكن تحضير المحلول منها بالوزن المباشر.
مواصفات المادة القياسية الأولية (Standard Specifications of the Initial):
- أن تكون المادة على درجة عالية من النقاوة.
- أن تكون المادة ثابتة أو مستقرة بدرجة حرارة الغرفة ولا تتأثر بمكونات الجو أي لا تكون متميعة أو متزهرة.
- أن يكون التفاعل بين المادة القياسية والمادة المراد معرفة تركيزها بسرعة وأن لا يكون التفاعل عكسي كما يجب أن تكون للمادة القابلية على الذوبان في المذيب المستعمل ضمن ظروف التجربة.
- يجب أن تكون المادة القياسية الأولية في متناول اليد أي يسهل الحصول عليها وليست غالية الثمن.
- يجب أن تكون المادة القباسية الأولية ذات وزن عالي حيث يزداد الوزن اللازم لتحضير المحلول القياسي بإزدياد الوزن المكافىء وتقل على ضوء ذلك بنسبة الخطأ النسبي في الوزن تكون قليلة. كما أنّ التفاعلات التي يشارك فيها المادة القياسية الأولية أثناء التسحيح يجب أن تكون آنية وسريعة وتسير نحو الكمال.
- يجب ألّا يكون محلول المادة القياسية الأولية ملوناً قبل انتهاء عملية المعايرة أو بعدها، منعاً لتداخل لونها مع لون الدليل المستعمل عند إيجاد نقطة إنتهاء التفاعل.
- يجب ألّا تتأثر بالضوء ودرجات الحرارة والغبار والمواد العضوية.
ومن أهم المواد التي تستعمل بوصفها مواد قياسية أولية موزعة على وفق تفاعلات التحليل الحجمي المركبات الآتية:
- القاعدة والحامضية (Base and Acid): كربونات الصوديوم، والبوراكس، وفثالات البوتاسيوم الحامضية، حامض الهيدروكلوريك ذو درجة غليان الثابتة، يوديدات البوتاسيوم الحامضية، حامض السكسنيك، حامض البنزويك، حامض الفورميك، حامض الأوكزاليك.
- الترسيب (Precipitation): الفضة، نترات الفضة، نترات الزئبقيك، كلوريد البوتاسيوم.
- التأكسد والاختزال (Oxidation and Reduction): ثنائي كرومات البوتاسيوم، برومات البوتاسيوم، أيودات البوتاسيوم، أيودات البوتاسيوم الحامضية، اليود، أوكزالات الصوديوم.
أما في حالة عدم الحصول على المادة بصورة نقية مثل عدد من الحوامض غير العضوية ومحاليل الهيدروكسيدات القلوية. فتحضر عندئد منها محاليل ذات تراكيز تقريبية، ثم تعين تراكيزها بالضبط مع محاليل قياسية ذات تراكيز معلومة مسبقاً. وتسمى هذه المحاليل باسم المحاليل القياسية الثانوية (Secondary Standard Solutions). وتدعى عملية تعيين تركيزها الصحيح بعملية المعايرة (Calibration Process).
عملية التسحيح (Process Titration): هي العملية التي تُستخدم لتعيين كمية المادة المذابة في المحلول (أ ي تركيزها) وتسمى (بالمادة المسَححة) من خلال إضافة حجم مضبوط من محلول قياسي ليتفاعل مع كمية المادة المسَححة ويعرف (بالمسِحح)، ويتم قياس حجمه بعناية بإستخدام سَحاحة من معرفة حجم ودرجة تركيز المسِحح يمكن تعيين كمية المادة المسَححة.
نقطة التكافؤ (Point of of Equivalence): هي النقطة التي عندها تكون الكمية المضافة من المسِحح الى المادة المسَححة متكافئة.
نقطة النهاية (End Point): هي النقطة التي يظهر فيها إكتمال التفاعل.
التخفيف (Diluting): وفيه تتم إضافة المزيد من المذيب الى محلول معين وبالتالي فإنّ تركيز المحلول يقل بسبب زيادة الحجم. إلا إنّ كمية المذاب تظل كما هي قبل وبعد التخفيف، وبالتالي فعدد المولات قبل التخفيف يساوي عدد المولات بعد التخفيف.
ونعلم أنّ عدد المولات يحسب من حاصل ضرب التركيز بالمولارية (M) في حجم المحلول باللتر أو المللتر:
M1 x V1 = M2 x V2
القانون:
M1: تركيز الكحلول الأبتدائي (قبل التخفيف)
M2: تركيز المحلول النهائي (بعد التخفيف – بعد إضافة مزيد من المذيب)
V1: حجم المحلول الإبتدائي ( قبل التخفيف – قبل إضافة المذيب)
V2: حجم المحلول النهائي ( بعد التخفيف – بعد إضافة المذيب)
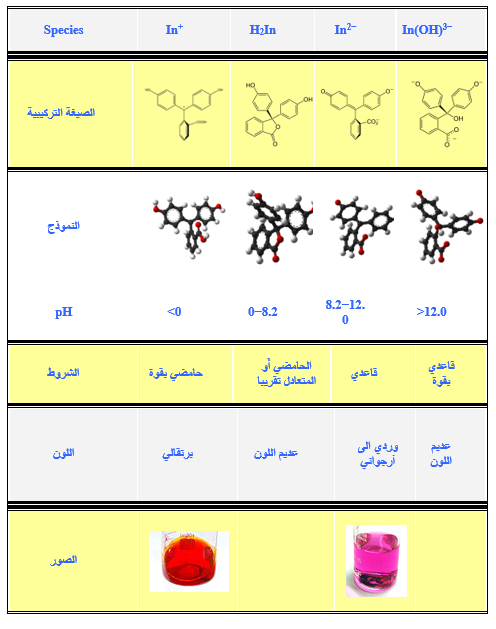
دليل الفينولفثالين (Phenolphthalein): وهو عبارة عن حامض ضعيف RH يتغير لونه في مجال pH يتراوح ما بين (10 – 8). يكون عديـم اللون عند قيم pH أقل من أو تسـاوي 8 (الشكل الحامضي غير المتأين). ويأخـذ اللون الأحمـر عند قيم pH أكبر من أو يسـاوي 10 (الشكل القلوي المتأين) ويأخذ اللون الوردي في المجـال pH المحصـور ما بين (10 – 8). ويكون عديم اللون عند المحيط القاعدي القوي كما مبين أدناه:
ويستخدم دليل الفينولفثالين عند تعادل الحوامض الضعيفة مع القلويات القوية في حين يستخدم المثيل البرتقالي عند تعادل القلويات الضعيفة مع الحوامض القوية.
RH ↔ H+ + R–
المخطط أدناه يوضح الصيغ التركيبية والألوان مع الصور في pH مختلفة لصبغة الفينولفثالين.
الأدوات والمواد المستعملة: ماصة، دورق مخروطي، سحاحة، حامل لتثبيت السحاحة، ماسك. هيدروكسيد الصوديوم، صبغة الفينولفثالين، حامض الهيدروكلوريك القياسي.
الجزء العملي : انقل (10 مل) بوساطة ماصة من محلول هيدروكسيد الصوديوم إلى دورق مخروطي ثم أضف قطرتين من صبغة الفينولفثالين وسححه ضد حامض الهيدروكلوريك المخفف القياسي النازل من السحاحة ذو (0.1 مولاري) أعد التجربة مرتين ثم احسب التركيز المولاري لهيدروكسيد الصوديوم.



























































