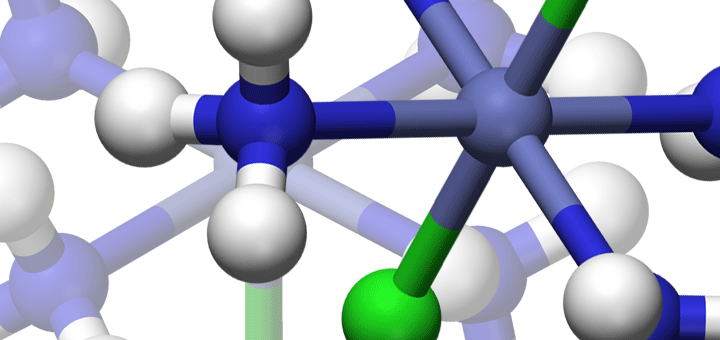
المعقدات الفلزية والأملاح المزدوجة
إنّ المركبات التي تتكون بوساطة الاتحاد النسبي لمادتين مشبعتين ظاهرياً أو أكثر، والتي هي نفسها قادرة على الوجود بصورة منفصلة عن بعضها تعرف بمركبات الإضافة أو بالمركبات الجزيئية. وهذه تقع في مجموعتين رئيستين:
1. الأملاح المزدوجة Double Salt
الملح المزدوج ينتج من الاتحاد بين مركبين بسيطين أو ملحين بسيطين يرتبطان بقوى ضعيفة نسبياً بحيث أنّ محلول الملح المزدوج يحتوي على جميع الأيونات المكونة للملحين الأصليين بحيث يمكن الكشف عن كل مكون على حدى أما المعقدات فلا يمكن الكشف عن مكوناته بالطرائق التقليدية وإنما يجب أن يحدث له تكسير Decomposition وهذه الأملاح المزدوجة توجد فقط في هيئة بلورية وتعاني تجزؤاً إلى مكوناتها عند إذابتها في الماء، مثل KAl(SO4)2.12H2O، (شب البوتاسيوم Potash alum)
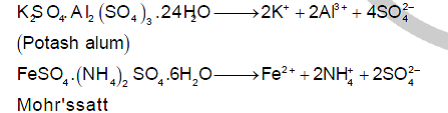
لكن الأملاح المزدوجة في أحيان كثيرة جداً تحتوي على أيونات معقدة قد توجد في أي جزء من الملح المزدوج. فمثلاً إنّ المركب KAl(SO4)2.12H2O يكتب بدقة أكبر بالشكل K+[Al(H2O)6]+3(SO4-2)2.6H2O، حيث أنّ الأيون Al(H2O)6]+3] يوجد في كل من الحالة الصلبة وحالة المحلول المائي. لذا يمكن أن يعرف الشب كالآتي:
الشب: عبارة عن أملاح مزدوجة أي تتكون من ملحين أحدهما كبريتات فلز ثلاثي التكافؤ مثل الحديد والكروم والألمنيوم والآخر كبريتات الفلز أحادي التكافؤ مثل (Na+) و (K+) و (NH4+)، له الصيغة Fe2(SO4)3.M12SO4.24H2O ويمكن كتابتها في الصورة
[M(H2O)6] [Fe(H2O)6][SO4]2
وهناك أملاح مزدوجة نوع ثاني تسمى الكرناليت (Carnllite)، ولها الصيغة KMgCl3 – 6H2O
KCl. MgCl2. 6H2O → K+ + Mg2+ + 3Cl– + 6H2O
تتميز هذه المركبات بأنها تحتفظ بتركيبها الجديد في الحالة الصلبة فقط بينما تتكسر إلى مكوناتها الأصلية إذا أذيبت في الماء وهذا النوع من المركبات يعرف بالأملاح الثنائية.
لو أذبنا الشب أو الكرناليت في الماء فإننا نستطيع الكشف عن الأيونات الداخلة في تركيبهما أي أنّ محاليل هذه المركبات تتخذ منحنى الأملاح البسيطة.
2. المعقدات الفلزية Metal Complexes
وهذه تحتفظ بهويتها في المحلول ويمكن استردادها منه. وعند الإذابة في الماء، تتحلل المعقدات إلى الأيون المعقد والأيون البسيط (عادة)، فمثلاً [K4[Fe(CN)6 عند ذوبانه في الماء لا يعطي أيون Fe+2 المجرد وأيون السيانيد CN– ولكنه يعطي الأيون المعقد Fe(CN)6]-4] وكما موضح:
K4[Fe(CN)6] ⇔ 4K+ + [Fe(CN)6]-4
كما أنّ المركب المعقد Cu(NH3)4]SO4] عند ذوبانه في الماء لا يعطي أيون النحاس (Cu+2)، بل يعطي الأيون المعقد Cu(NH3)4]+2] أي أنّ مركبات هذه المجموعة تحتفظ بتركيبها في الحالة الصلبة والمحاليل.
التركيب الأساسي للمعقدات
المركبات التناسقية أو المعقدات الفلزية (Metal Complexes) يمكن تعريفها بصورة عامة كالآتي:
يتكون المركب التناسقي من اتحاد ذرة أو أيون مركزي (M) مع واحد أو أكثر من الليكاندات Ligands – L والتي تمتلك أزواج منفردة من الاكترونات القادرة على وهبها الى الأوربيتالات (المدارات) الفارغة لذرة الفلز أو الأيون والتي تتحد اتحاداً مباشراً مع الأيون الفلزي المركزي الموجب بحيث يتعدى هذا العدد التكافؤ الاعتيادي لهذه الذره (أي حالة الأكسدة لها)، لتكون مجموعة من المعقدات ML, ML‘, ML2… الخ. تهب الليكاندات زوج من الإلكترونات إلى الفلز المركزي، ويحمل المعقد شحنه تتعين بمقدار شحنة الأيون الفلزي وشحنة الليكاندات المحيطة به. قد يكون المعقد المتكون عبارة عن مركب مثل [K2[Cu(CN)4 أو يكون المعقد مشحوناً بشحنة كهربائية مثل: Cu(CN)4]-2] أو Cu(NH3)4]2+,[Co(NH3)6] +3] و [K3[Fe(CN)6. وكما في المثال:
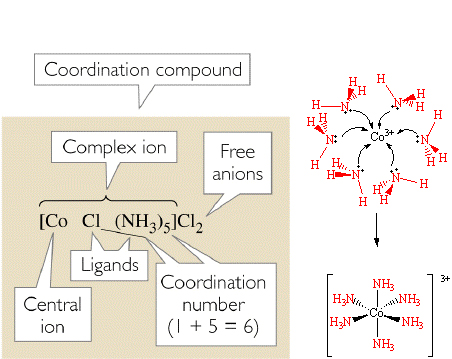
يتضح من العدد الكلي لليكاندات الموجودة في معقد يتفق مع العدد التناسقي لذرة الفلز المركزي أو الايون المركزي، مثل [K3[Fe(CN)6 بوتاسيوم سداسي سيانوحديدات (III) ففي هذا المعقد يحاط أيون الحديد (III) المركزي بست ليكندات من –CN أيون السيانيد. يكتب المعقد الأيوني محصوراً بين قوسين مستقيمين، أي Fe(CN)6]-3]. وفي المركب بوتاسيوم سداسي سيانو حديدات (III)، تكون النسبة الجزيئية لأيونات البوتاسيوم إلى أيونات Fe(CN)6]-3] هي 1:3 وذلك لغرض بلوغ التعادل الكهربائي.